







Introdução Com a intenção de auxiliar na busca por uma nova oportunidade de emprego, apresentamos a vaga de Padeiro na cidade de Indaiatuba, São Paulo, oferecida...



A Secretaria Municipal de Cultura tem o prazer de convidar a população para a 3ª edição do evento ‘Abriu para o Jazz’. O evento será realizado...



Introdução A Campanha do Agasalho 2024 é uma iniciativa solidária realizada em conjunto pelo Fundo Social de Solidariedade (Funssol) e a EPTV. Esta ação beneficente tem...
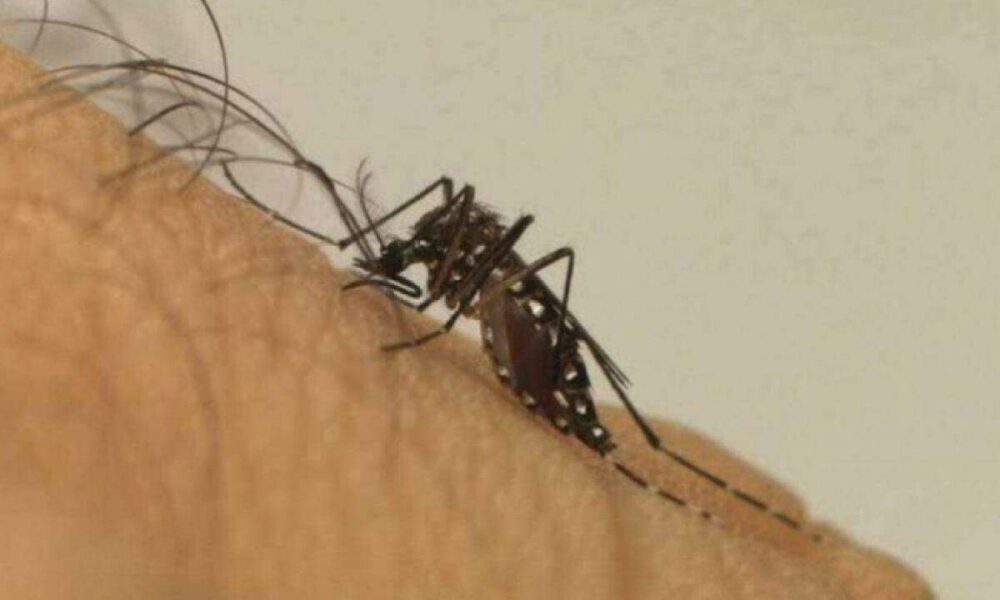


Introdução A cidade de Campinas, um importante polo metropolitano, está enfrentando uma notória aceleração nos casos de dengue. Até o momento foram registrados mais de 52,8...



Em uma recente ação que se tornou centro das atenções, o prefeito de Campinas, Dário Saadi, expressou sua postura inabalável contra as invasões de terras. Esta...



Publicado em 20/04/2024 as 14:00 Atualizado em 20/04/2024 as 14:05 Restaurante Via Brasil em Itu: 25 anos de sabor e frisante para os clientes (Foto: Arquivo...



> ‘Uma unidade móvel de cuidados veterinários se torna alvo de atos destrutivos e roubo no Parque Dom Bosco, interrompendo os serviços oferecidos aos animais da...



1. Introdução A Sanasa, empresa que administra o saneamento em Campinas, planeja realizar obras para interligar a rede de água no Jardim Santo Expedito em razão...


Um total de 75 vagas gratuitas em três modalidades diferentes serão oferecidas Publicado em 15/04/2024 às 15h09 | Indaiatuba | Cidades Indaiatuba (SP), uma cidade vibrante...



A saúde ocular na primeira infância é essencial para o desenvolvimento e aprendizado adequado. O Prefeito de Indaiatuba, Nilson Gaspar, entende a importância desse fato e,...